心梗恢复新希望!100项研究,从5大方面深度解析干细胞治疗最新进展和未来发展方向
来源: 发布日期:2025-07-28 浏览次数:1979次
缺血性冠状动脉疾病是导致死亡的主要原因之一,冠状动脉疾病常恶化为心肌梗死(也称心梗),冠状动脉闭塞会导致局部缺血,造成肌性心肌广泛坏死、不良心室重塑和纤维化瘢痕形成。
目前再灌注治疗(包括介入、溶栓和搭桥)是心梗标准疗法,虽可快速恢复冠脉血流,但无法促进受损组织再生,心梗后数年内的并发症仍是主要死因,亟需能够实现心脏功能完全恢复的新型疗法。
近年来,干细胞疗法的快速发展为多种难治性疾病开辟了潜在治疗途径,它能分化为心肌细胞,并可诱导旁分泌信号通路、血管生成和免疫调节,还能提高左心室射血分数(LVEF) 并减少梗死区域瘢痕组织增生。
2025年5月,国外学者在《Biomedicines》(生物医学)期刊发表一篇关于干细胞治疗心梗的最新综述研究,该综述从5大方面阐述了干细胞疗法在心梗修复中的治疗潜力,并梳理该领域最新进展以及未来发展方向。

接下来介绍一下目前与心脏修复相关的常见干细胞/祖细胞,图1简要概述了文献中用于心脏修复不同干细胞类型的常见来源。
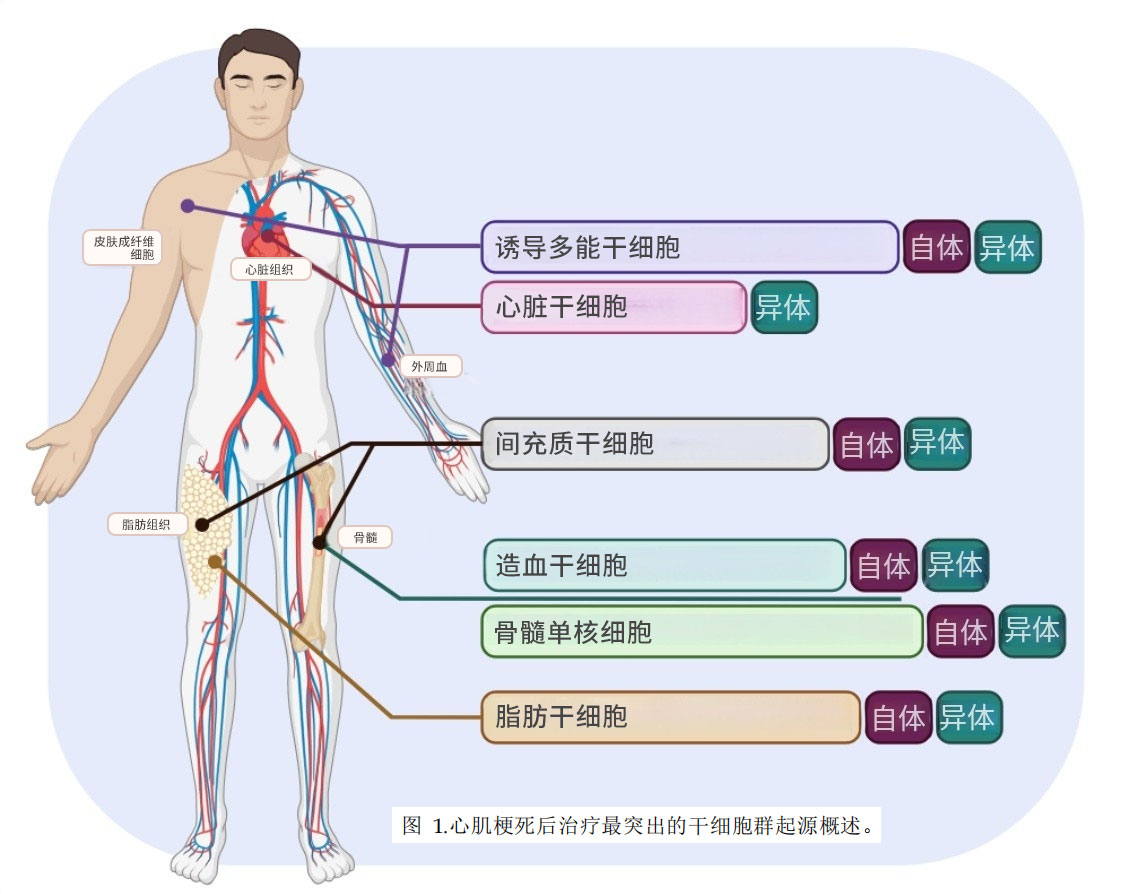
一、目前心梗研究常用干细胞类型
1.心脏干细胞(CSC)
CSC是心脏内多能前体细胞(其分布稀疏且增殖缓慢),可分化为心肌细胞、内皮细胞或平滑肌细胞,它在胚胎发育过程中指导心脏发生,并在一定程度上参与心脏修复。由于心脏环境的抗增殖特性,成人组织中CSC自然修复能力有限。
CSC在体内数量较少,可通过体外扩增达到移植需求,但由于分离制备限制,需依赖同种异体来源,如心脏移植残留心房组织或切碎的供体心脏,虽然移植后增加了GVHD风险,但多数研究表明CSC移植后未显著增加重大心血管不良事件(MACE)发生率。
2.间充质干细胞(MSC)
MSC是迄今为止研究最深入的干细胞之一,它是一种多能性基质干细胞,可从多种组织中分离,包括骨髓、脂肪组织和脐带组织,还具有分化成多种细胞谱系的能力,包括软骨细胞、心肌细胞,甚至神经元。
MSC在心肌修复中的优势可能更多地在于其旁分泌信号传导能力和/或募集内源性干细胞进行修复能力,而不是直接向心肌细胞分化。这一机制规避了细胞移植存活率低的问题,还能通过多靶点调控实现更高效修复。
鉴于MSC在体内普遍存在且在体外可持久存在,自体和同种异体MSC均已被广泛用于心梗临床研究,且疗效相似,无论是同种异体MSC其在心梗后恢复中的作用均显示出良好的安全性结果。
3.骨髓单核细胞(BMMC)
从技术上讲,BMMC不是同质干细胞群,而是在骨髓中发现的祖细胞/多能干细胞群,包括造血干细胞(HSCs)、内皮祖细胞(EPCs)和MSCs等。尽管它是由不同祖细胞组成的混合体,但它也是临床应用最多的细胞类型之一。
由于其细胞组成多样,BMMC表现出广泛分化潜力,它们能够分化为构成细胞所能提供的所有谱系。除此之外,由于不需要大量体外培养,它们具有较快周转时间,为自体急性心梗治疗提供了罕见的可能性。
多数研究显示,BMMC治疗对心梗后心功能改善有限,可能由于其成分被非相关的祖细胞“稀释”。但因MACE和其它风险因素较低,BMMC疗法仍是心梗有前景候选者,因为其与同质干细胞群(如MSC)或与冠状动脉旁路移植(CABG)联用可产生协同修复作用。
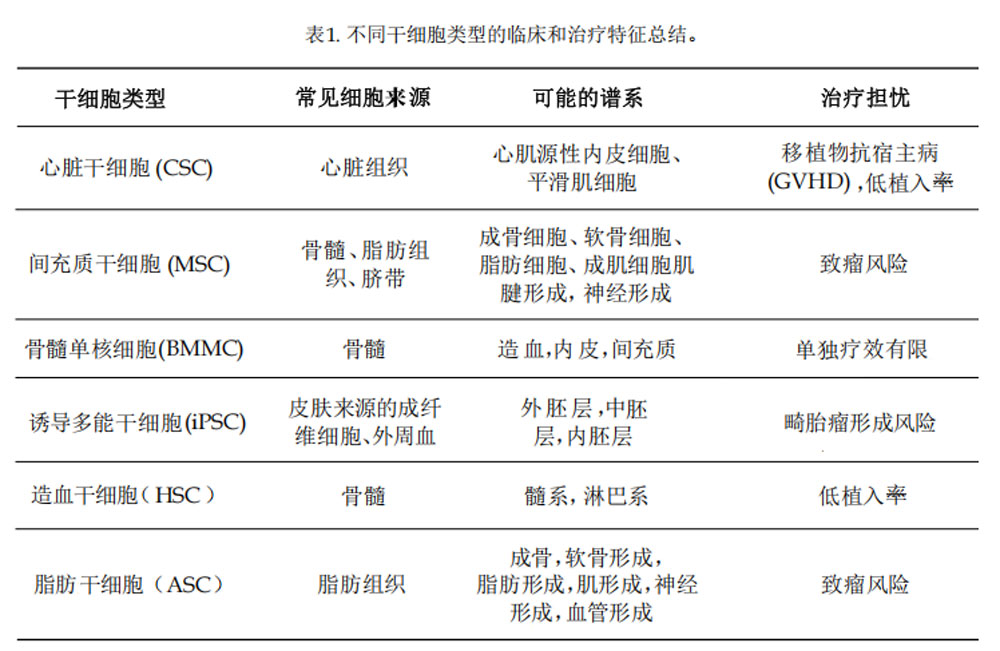
4.诱导性多能干细胞(iPSC)
iPSC是通过基因重编程将成体细胞(如皮肤成纤维细胞或外周血细胞)逆转为多能状态的干细胞,具有类似胚胎干细胞(ESC)的全能分化潜力。其多能性和低供体变异性使其在自体/异体治疗中极具应用前景。
iPSC的多能性优势也带来了巨大挑战,尤其是移植后形成畸胎瘤的风险。因此,有人提出在移植前将iPSC作为CSC或MSC分化起始群体,以最大限度地提高效益并最大限度地降低风险。
在心梗后心脏修复背景下,iPSC显示出独特优势:Yang等人通过2D/3D培养证实其可分化为心肌细胞,并分泌促血管生成因子。若能控制肿瘤风险,iPSC或将成为最具潜力的同质干细胞疗法。
5.造血干细胞(HSC)
HSC是一种主要来源于骨髓和外周血的干细胞,在所有血系中均表现出多能性,可从同种异体和自体来源获取,每年的治疗性移植大致在这两种来源之间分配(分别为47%和53%)。
HSC虽不能直接分化为心肌细胞,但临床前研究显示其旁分泌效应显著。Shalaby团队在小鼠心梗模型中发现,HSC治疗可减少胶原沉积、改善心脏结构(比MSC能更有效缩小梗死面积),并上调关键修复因子。
6.脂肪干细胞(ASC)
ASC是从脂肪组织中获得的一种MSC亚群。与其它MSC一样,具有多能性,能够分化为多种细胞类型,包括成骨、成软骨和成脂肪谱系。它与骨髓来源的MSC也有许多功能相似之处,但其在脂肪组织中更易于获取且数量较多。
ASC虽与其它MSC具有相似的再生和旁分泌功能,但其独特的免疫调节特性使其成为治疗多种病症的潜在候选者。多项心梗动物模型研究显示,ASC治疗潜力至少与其它来源的MSC相当。
二、干细胞在心梗恢复中的作用
1.修复和血管生成
干细胞疗法通过分化为血管相关细胞促进心脏血管生成,该机制对缺血组织修复尤为关键,新生血管能增强冠脉循环效率,由心梗触发后可减少心肌细胞死亡并抑制瘢痕形成,是改善血流的核心病理修复过程。
2.细胞外和旁分泌信号转导
植入体内的干细胞主要通过旁分泌信号传导等机制(释放趋化因子/生长因子)发挥心脏再生作用,而非直接分化为心肌细胞。这些因子通过调控炎症、促进血管新生、募集内源干细胞及重启心肌细胞周期实现协同修复作用。
3.细胞外囊泡(EV)
EV通过运输蛋白/核酸等生物分子介导心脏再生和修复,其中外泌体最具潜力,因为它们源自多种干细胞且致瘤风险极低,还能促进心肌细胞增殖、血管生成、抗炎反应,并通过基因调节减少梗死面积和细胞凋亡,显著改善心脏功能。
三、给药方法和时间
干细胞给药方式的选择需综合考虑手术类型(开胸/导管)、冠脉狭窄程度及心肌梗死时间(急性期<7天/亚急性7-14天/慢性期>14天)。由于每个阶段心肌都会发生复杂变化,因此给药时机也是一个重要因素。
1.直接心肌内注射
直接心肌内注射涉及针对心肌特定梗死区域,这些区域通过核成像和/或心脏超声心动图识别。在开胸开胸手术中,例如冠状动脉搭桥术或作为独立手术,包括侧部小切口开胸术,将干细胞直接注射到梗死区域。
直接心肌注射虽能实现高细胞保留率(无需归巢过程),但作为开胸手术具有显著侵入性,可能导致心律失常、心肌穿孔等并发症。局限性在于仅能靶向特定心肌区域、恢复期长、不可重复操作,且存在细胞从注射位点流失风险。
2.静脉输液
静脉输注主要用于急性心梗,因为成功率很大程度上取决于濒死心肌释放的信号分子,这种方法很有吸引力,因为与其它方法相比,侵入性小且易于管理。它在涉及多个梗死区域的病例中也特别有用,因为干细胞会迁移到心脏的任何梗死区域。
其局限性在于输注的干细胞容易滞留在肺部,导致输送效率低、心肌保留率低,这会降低治疗效果。与直接心肌注射相比,左心室射血分数的改善也较小。
3.冠状动脉内输液
冠状动脉内输注通过球囊导管经股动脉靶向递送干细胞,可采用停流(球囊阻断减少体循环流失)或持续血流两种注射模式。该技术能显著改善左心室功能、抑制心室重塑、缩小梗死面积,并提升患者生活质量与临床预后。
冠状动脉内输注较静脉输注能精准递送干细胞至病灶,提升心肌细胞保留率,且可结合常规心导管检查同步完成。但存在冠脉损伤、微栓塞风险,限制细胞剂量/大小,对低灌注区递送困难。缺氧环境影响存活率,且细胞可能经心肌二次转移至肺循环。
4.使用导管进行心肌内给药
①心内膜注射:通过机电映射精准靶向梗死交界区,可显著改善左心室射血分数并缩小梗死面积,细胞保留率高且并发症少,但需特殊设备并存在穿孔和心律失常风险。
②冠状静脉注射:经皮微创操作,利用血管内超声实现细胞均匀分布,可规避开放性手术风险,但受静脉解剖变异影响定位精度,仍存在心律失常风险和肺部再分布等风险。
③逆行冠状静脉系统:经股静脉-冠状窦路径隔离注射,适用于冠状动脉阻塞患者,栓塞风险低于冠状动脉内注射,但静脉迂曲增加操作难度,冠状窦损伤风险需警惕。
四、临床和临床前试验总结
通过分析各种治疗心梗的干细胞疗法临床和临床前研究后,发现MSC和自体心脏球体衍生细胞(CDC)显示出更好的应用前景。
一项多中心对照试验经皮冠状动脉介入治疗后冠状动脉内输注MSC,注射后4个月内LVEF增加了8.8%,而对照组则仅增加了4.8%。还发现多剂量MSC输注使LVEF功能改善了7.45%,而单剂量仅改善了4.54%。

另一项随机对照试验中,经冠状动脉内输注CDC,在一年随访中显著减少了瘢痕大小(−11.1%),并增加了存活心肌(22.6%)。与单纯进行CABG相比,增强左心房功能。总体而言,干细胞注射未出现重大安全问题或不良事件。
五、细胞存活和保留限制
研究发现,只有极少数(大约1%或更少)干细胞在移植后能够长期存活,缺血、炎症和心肌的机械性冲洗是导致细胞显著损失的主要因素。此外,冠状内或静脉输注也会受到快速冲洗的影响,这限制了有效的细胞植入。
为提高急性期细胞保留率,新型递送策略(心肌内注射/可注射水凝胶/心外膜贴片)通过构建仿生细胞外基质,使细胞保留率较生理盐水提升8-59倍。鉴于细胞存活率瓶颈,医学界推荐采用干细胞外泌体作为替代方案,其既能携带修复信号又可规避细胞存活难题。
未来发展方向
目前已有学者尝试将基因编辑与干细胞和生物打印技术融合进行相关试验。未来随着学者们的不断探索,开发出一种特定的心脏贴片,将为心脏再生开辟一条新的治疗途径。目前研究重点是促进工程化组织的成熟度,确保其与宿主心肌的机械和电气融合,并建立稳健的血管网络,以支持植入后组织活力。
总 结:上述分析结果表明,干细胞疗法通过多种机制展现出良好治疗潜力,临床数据显示,心肌内注射MSC可安全改善左心室功能,冠脉内CDC能降低LVEDV/LVESV等指标,冠状动脉搭桥术联合BM-MNC可增强心房功能。
虽然干细胞疗法展现了治疗优势,但还存在三大瓶颈:①细胞保留率低,②未能显著改善无事件生存期/疤痕缩小等硬指标,③潜在致瘤及免疫等风险。为了实现一致和持久的临床益处,有必要进一步优化细胞来源、递送方法。
参考资料:
Le, N.T.; Dunleavy, M.W.;Zhou, W.; Bhatia, S.S.; Kumar, R.D.;Woo, S.T.; Ramirez-Pulido, G.;Ramakrishnan, K.S.; El-Hashash, A.H.Stem Cell Therapy for MyocardialInfarction Recovery: Advances,Challenges, and Future Directions.Biomedicines 2025, 13, 1209.https://doi.org/10.3390/biomedicines13051209.















