细胞疗法治疗创伤性视神经病变:最新进展、挑战与未来展望
来源: 发布日期:2026-01-15 浏览次数:626次
创伤性视神经病变(TON)是由外力作用于头面部导致的视神经损伤,常引起视网膜神经节细胞(RGC)进行性死亡和轴突变性,最终导致不可逆的视力丧失。
当前临床治疗手段(如皮质类固醇和视神经减压术)疗效有限,而基于细胞的疗法因其在神经保护、轴突再生和细胞替代方面潜力,逐渐成为研究热点。
近期,有学者发表了一篇关于TON综述研究,系统分析了TON细胞疗法最新进展,重点探讨了ESCs/iPSCs衍生的RGC样细胞、MSCs、NSCs及细胞衍生产品(如细胞外囊泡)作用机制、临床前模型及临床试验成果,并分析了该领域面临的挑战与未来方向。

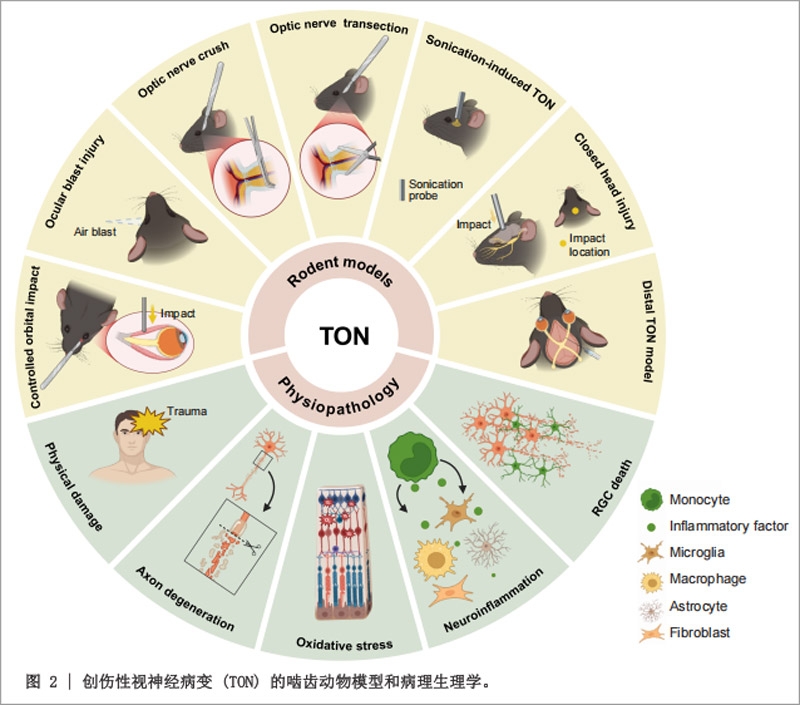
一、TON病理机制与动物模型
TON病理过程分为原发性损伤(机械性视神经损伤)和继发性损伤(氧化应激、神经炎症、胶质瘢痕形成等)。RGC死亡涉及多种细胞凋亡途径(如凋亡、焦亡、铁死亡),且不同RGC亚型对损伤敏感性存在差异。
为模拟TON,研究者开发了多种啮齿动物模型,包括视神经挤压伤(ONC)、视神经横断、眼部爆炸伤、超声诱导模型等,其中ONC模型因能模拟临床常见轴突变性和RGC渐进性死亡,成为最广泛应用工具。
二、细胞疗法作用机制与进展
1. 人ESCs分化为RGC样细胞
通过化学诱导或直接重编程技术,ESCs/iPSCs可分化为RGC样细胞,用于替代受损RGC。平面分化(如使用小分子调控BMP、TGF-β信号通路)和三维视网膜类器官分化均可生成高纯度RGC样细胞,标志物包括BRN3A、THY1、RBPMS等。
研究表明,这些细胞能在宿主视网膜神经节细胞层整合并存活数周至数月,部分研究还观察到其延伸轴突至视神经。例如,人iPSC来源RGC样细胞在ONC模型中迁移至视神经乳头,并促进内源性RGC存活。
挑 战:分化效率、移植细胞存活率、功能整合及肿瘤形成风险等仍需优化。
2. MSCs的神经保护作用
MSCs来源于骨髓、脂肪、脐带等组织,通过旁分泌机制(分泌BDNF、VEGF、CNTF等神经营养因子)发挥神经保护和免疫调节功能。在ONC模型中,MSCs移植可显著提高RGC存活率、促进轴突再生,并部分恢复视觉功能。
例如,有研究发现,脐带来源MSCs能长期存活,且优先保护抗损伤能力强的α-RGC亚型;联合疗法(如MSCs与雪旺细胞共同移植)或基因修饰(如过表达PEDF)可进一步增强疗效。
局限性:MSCs在玻璃体内滞留时间有限,需要优化给药策略或结合生物材料以延长其疗效。
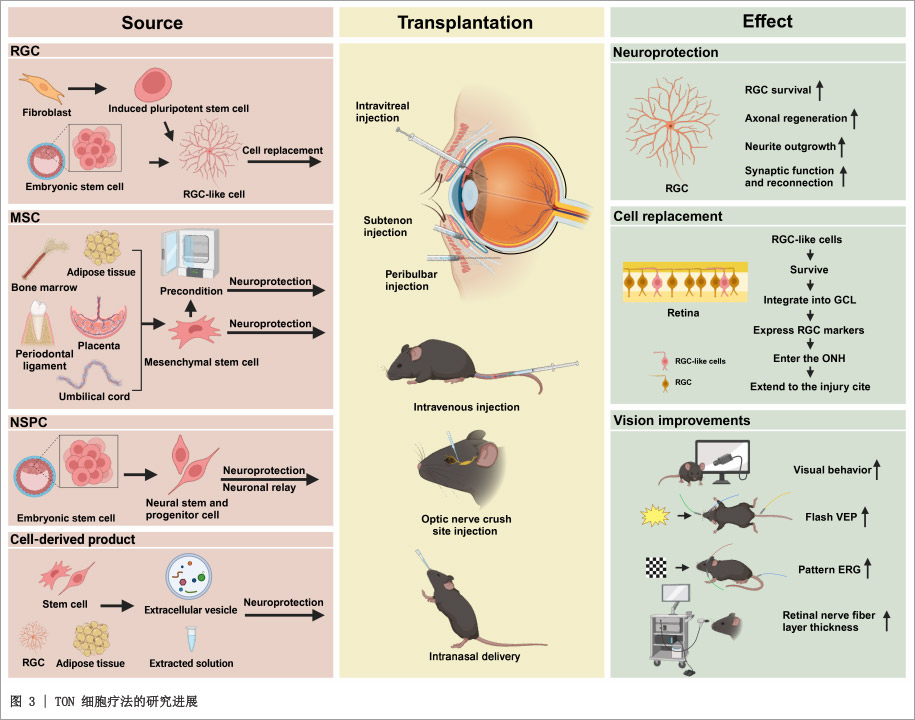
3. NSCs/NSPCs的“神经中继”功能
人ESCs来源的NSPCs不仅能分泌神经营养因子,还可分化为神经元,在损伤部位与宿主视觉通路之间建立连接。
在视神经横断模型中,移植的NSPCs延伸轴突至视交叉,接收再生RGC的突触输入,充当“神经中继站”。此外,NSPCs通过激活Wnt/β-catenin通路增强线粒体功能,抑制RGC死亡。
不 足:目前相关研究较少,长期功能恢复效果需进一步验证。
4. 细胞衍生产品:细胞外囊泡(EVs)与无细胞提取物
EVs是纳米级脂质双层囊泡,携带miRNA、蛋白质等活性成分,具有低免疫原性、高靶向性和无肿瘤风险等优势。
研究显示,hiPSC-NSPC来源的小EVs可通过递送神经保护性miRNA抑制小胶质细胞活化;MSCs-EVs能募集修复性巨噬细胞,促进轴突再生;无细胞脂肪提取物(CEFFE)富含抗炎因子,亦能显著改善RGC存活。
挑 战:EVs在体内清除速率快,需开发缓释载体(如生物材料支架)以延长疗效。
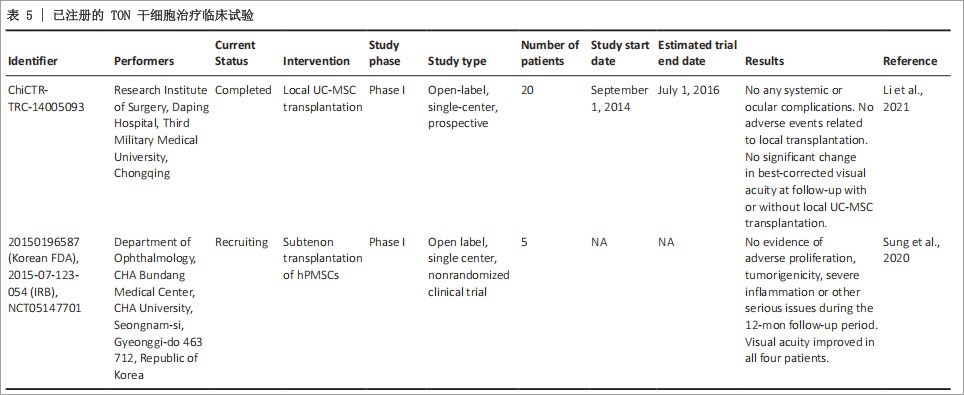
三、临床试验与安全性
目前有两项I期临床试验(NCT05147701和ChiCTR-TRC-14005093)初步验证了细胞疗法治疗TON的安全性。
其中一项人胎盘来源MSCs球结膜下移植,在4例TON患者中未引起严重不良反应,并且视力得到明显改善;另一项脐带MSCs联合明胶海绵支架移植亦显示良好耐受性和有效性。然而,样本量小和术前视力差异等因素限制了其疗效的统计学显著性。
四、面临的挑战
1.细胞来源与优化:人ESCs/iPSCs来源的RGC,需提高其分化效率和纯度,避免畸胎瘤风险;改变MSCs预处理(如缺氧条件)方式或可增强其分泌功能。
2.移植策略:内界膜(ILM)是细胞整合的物理屏障,需探索酶处理或生物材料支架(如聚多巴胺纳米支架)以促进细胞迁移。
3.功能重建:再生轴突的髓鞘化及与视觉中枢的正确连接是恢复视功能的关键,需结合电刺激或3D打印引导技术。
4.临床转化:需在更多灵长类模型中验证疗效,并标准化细胞制备、给药途径和长期随访方案。
五、总结与未来方向
现有研究表明,细胞疗法为TON提供了从神经保护到细胞替代的多层次治疗策略,尽管在临床前研究中展现出显著潜力,但其临床应用仍面临整合效率、长期安全性及功能恢复稳定性等挑战。
未来通过结合基因编辑、生物工程和影像技术,有望突破现有瓶颈,实现TON视神经再生,从而造福更多患者。
参考资料:
Wang Y. et al. Cell-based therapies for traumatic optic neuropathy: Recent advances, challenges, and perspectives. Neural Regen Res 21(5):1961-1980.10.4103/NRR.NRR-D-24-01322.
















