干细胞治疗阿尔茨海默病的安全性和耐受性:I期临床试验
来源: 发布日期:2023-11-21 浏览次数:361次
阿尔茨海默病(AD)是一种与年龄相关的神经退行性疾病,也是痴呆症的最常见原因。由于AD具有多种病理机制,因此有学者提出多靶点治疗可能比单靶点治疗更有效地改变疾病的临床病程。

临床前研究表明,将人脐带来源的间充质干细胞(UC-MSCs)注射到AD小鼠模型的大脑中时,MSCs会分泌多种细胞因子,帮助解决了AD的多种病理机制。
UC-MSCs分泌的可溶性细胞内粘附分子-1(sICAM-1)和AgRP可降低β淀粉样蛋白(Aβ)水平,还通过分泌GDF-15和激活素A增强内源性成体神经发生和突触活性,hUCB-MSC来源的半乳糖凝集素-3可以防止Aβ神经毒性。

基于这些基础研究,Hee Jin Kim等人完成了一项关于AD的I 期临床试验(NCT02054208),他们将UC-MSCs立体定向注射到9名AD痴呆患者的海马和楔前叶中,通过研究确认了MSCs治疗AD的安全性和耐受性,研究结果已在《Alzheimer's Research & Therapy》期刊发表。
该研究是一项开放标签、单中心I期临床试验,主要目的是评估脑室内重复注射UC-MSCs治疗AD的安全性和剂量限制毒性。共纳入了9名患者,年龄50~85岁,精神状态检查(MMSE) 分数为18~26分。
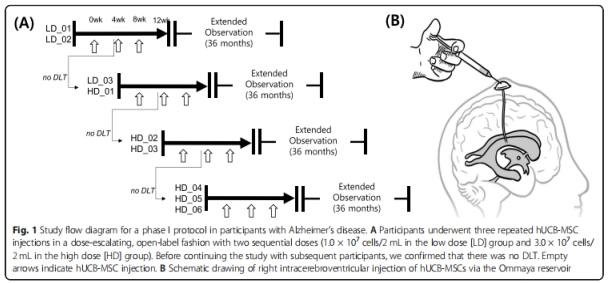
方 法:获得当地相关机构批准以及患者的书面知情同意书后,研究人员在局部麻醉下将Ommaya储库植入参与者右侧脑室,4周后,参与者接受第一次UC-MSCs注射,间隔4周,再重复2次UC-MSCs注射(图 1A、B)。分为低剂量(1*107/2 mL)组和高剂量(3*107/2 mL)组。
结 果:①安全性:常见的不良事件有发烧、头痛、恶心和呕吐,根据 CTCAE判断,不良事件的程度为1级,这些不良事件均在36小时内自然消退。此外,有5名参与者完成了36个月的延长观察研究,没有观察到进一步的严重不良事件。
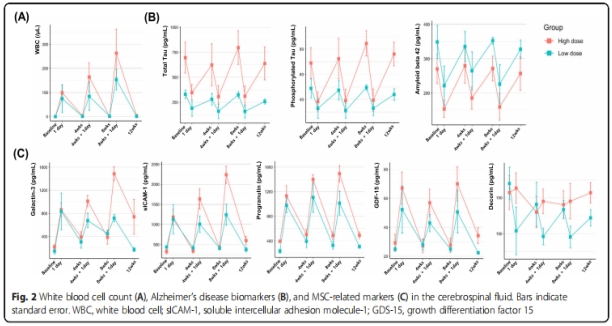
②生物标志物检测:每次UC-MSCs注射后1天,脑脊液白细胞计数增加,4周后恢复正常(图2A);每次UC-MSCs注射后1天,AD生物标志物下降,4周后增加到基线水平(图2B);UC-MSCs相关标志物(Galactin-3、sICAM-1、progranulin和GDF-15)在每次注射后1天增加,4周后降至基线水平,但在脑脊液其它标志物中没有观察到这种情况(图2C)。
③患者实质Aβ沉积变化:通过淀粉样蛋白-PET测量的Aβ负荷显示,在低剂量组的2名参与者中,PiB标准化摄取值(SUVR)从基线时的2.57 ± 0.40下降到治疗后的1.92 ± 0.03;在低剂量组的另1名参与者中,florbetaben PET的SUVR从基线时的1.70下降到治疗后的1.60;高剂量组中,florbetaben SUVR从基线时的1.79 ±0.07下降到治疗后的1.71 ± 0.06。
总 结:在这项 I 期临床试验中,我们将UC-MSCs重复注射到9名轻中度AD痴呆患者的右侧脑室中,仅有部分患者产生了一些轻微不良反应,表明UC-MSCs似乎是一种可行、安全且耐受性的治疗方法。
该研究的局限性在于试验中使用的UC-MSCs注射剂量是基于小鼠与人脑脊液体积比计算的,未来还需要进一步开展详细研究来评估AD患者的最佳细胞剂量。
参考资料:
Hee Jin Kim, Kyung Rae Cho, Hyemin Jang, Na Kyung Lee, Young Hee Jung, Jun Pyo Kim,Jung Il Lee, Jong Wook Chang, Seongbeom Park, Sung Tae Kim, Seung Whan Moon,Sang Won Seo, Soo Jin Choi and Duk L. Na. Intracerebroventricular injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer’s disease dementia: a phase I clinical trial. https://doi.org/10.1186/s13195-021-00897-2.















